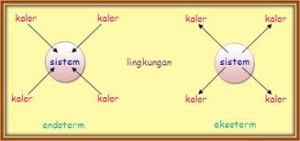
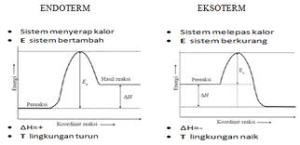
Reaksi Eksoterm dan Reaksi Endoterm
- Reaksi Eksoterm : reaksi yang melepaskan kalor atau menghasilkan energi.
Hakhir < Hawal
Hakhir – Hawal < 0
H berharga negatif (-)
- Reaksi Endoterm : reaksi yang menyerap kalor atau menerima energi
Hakhir > Hawal
Hakhir – Hawal > 0
H berharga positif (+)
F. Persamaan Termokimia
Contoh:
- Pada pembentukan 1 mol air dari gas hydrogen dan gas oksigen pada 25oC (298 K), 1 atm, dilepaskan kalor sebesar 286 kJ.
H2(g) + ½ O2(g) → H2O ∆H = -286 kJ
2H2(g) + O2(g) → 2H2O ∆H = – 572 kJ
- Reaksi karbon dan gas hydrogen membentuk 1 mol C2H2 pada temperature 25oC dan tekanan 1 atm memerlukan kalor sebesar 226,7 kJ
2C(s) + H2(g) → C2H2 ∆H = +226,7 kJ
Apabila pengukuran ∆H dilakukan untuk 1 mol zat pada kondisi standar, maka ∆H sama dengan entalpi molar dengan satuan kJ/mol.
G. Perubahan Entalpi Standar (∆Ho)
1. Perubahan entalpi pembentukan standar (∆Hof)
: perubahan entalpi yang terjadi pada pembentukan 1 mol zat dari
unsur-unsurnya diukur pada keadaan standar. Biasanya bersifat Endoterm.
UNSUR → SENYAWA
Contoh :
Ag(s) + ½ Cl2(g) → AgCl2(s) ∆Hof = – 127 kJ/mol
K(s) + Mn(s) + 2O2(g) → KMnO4 ∆Hof = – 813 kJ/mol
2. Perubahan entalpi penguraian standar (∆Hod)
: perubahan entalpi yang terjadi pada penguraian 1 mol zat menjadi
unsur-unsurnya diukur pada keadaan standar. Biasanya bersifat Eksoterm.
SENYAWA → UNSUR
Contoh :
AgCl2(s) → Ag(s) + ½ Cl2(g) ∆Hof = + 127 kJ/mol
KMnO4→ K(s) + Mn(s) + 2O2(g) ∆Hof = + 813 kJ/mol
3. Perubahan entalpi pembakaran standar (∆Hoc) : perubahan entalpi yang terjadi pada pembakaran 1 mol unsur atau senyawa diukur pada keadaan standar. Bersifat Eksoterm.
SYARAT : BEREAKSI DENGAN OKSIGEN
Contoh :
CH4(g) + O2(g) → CO2(g) + 2H2O(g) ∆Hoc = – 889,5 kJ
C2H2(g) + O2(g) → 2CO2(g) + H2O(g) ∆Hoc = – 129,9 kJ
4. Perubahan entalpi netralisasi (∆Hon) : perubahan entalpi yang terjadi pada saat asam dengan basa baik tiap mol asam atau basa.
ASAM + BASA → H2O
Contoh :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆Hon = – 57,1 kJ
H. Penentuan ∆H Reaksi
1. Penetuan ∆H reaksi melalui eksperimen Þ Kalorimeter
Q = m.c.∆T dimana ∆H = – Q
Contoh :
1. Di dalam calorimeter terdapat zat yag
bereaksi secara endoterm. Reaksi tersebut menyebabkan 1 kg air terdapat
dalam Kalorimeter mengalami penurunan suhu 5oC. Tentukan kalor reaksi dari reaksi tersebut.
Q = m.c.∆T
= 1000 gr x 4,2 J.g-1.c-1 x 5oC
= 21000 J ≈ 21 kJ
2. 50 mL larutan HCl 1 M yang suhunya 22oC dicampurkan dengan 50 mL larutan NaOH 1 M yang suhuny 22oC. pada reaksi tersebut terjadi kenaikan suhu sampai 28,78oC. Tentukan entalpi netralisasi dan tulis persaman termokimianya.
Jumlah mol HCl = 50 mL x 1 M = 50 mmol ≈ 0,05 mol
Jumlah mol NaOh = 50 mL x 1 M = 50 mmol ≈ 0,05 mol
Volum larutan = volume air = 100 mL
Massa larutan = massa air = 100 mL x 1gr/ml = 100 gr
Suhu awal = 22oC
Q = m.c.∆T
= 100 gr. 4,2 J.g-1.c-1 x (28,78 – 22) oC
= 2885,4 J ≈ 2, 8854 kJ
∆H = – Q
= – 2,8854 kJ ≈ ∆Hn untuk 0,05 mol H2O
∆Hn untuk 1 mol H2O = - 57,71 kJ/mol
Persamaan termokimia :
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ∆H = – 57,71 kJ
2. Penentuan perubahan entalpi berdasarkan entalpi pembentukan
∆Hreaksi = ∑∆Hproduk – ∑∆Hreaktan
Setiap unsur bebas memiliki harga entalpi = 0
Contoh :
Tentukan perubahan entalpi reaksi pembentukan C2H8, jika diketahui:
∆Hof C2H6 = – 84,7 kJ/mol
∆Hof CO2 = – 393,5 kJ/mol
∆Hof H2O = – 285,5 kJ/mol
Jawab :
C2H6 + 3 ½ O2 → 2CO2 + 3H2O
∆Hreaksi C2H6 = [ 2 x ∆Hof CO2 + 3 x ∆Hof H2O] – [∆Hof C2H6 + 3 ½ x ∆Hof O2]
= [2 x - 393,5 kJ/mol + 3 x - 285,5 kJ/mol] – [- 84,7 kJ/mol + 3½ x 0 kJ/mol]
= – 1559,7 kJ/mol
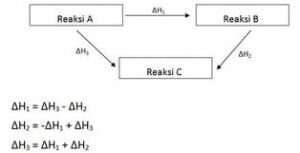
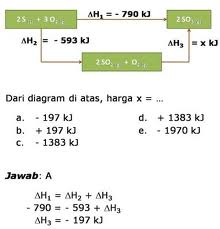
3. Penentuan perubahan entalpi berdasarkan Hukum Hess
Perubahan entalpi hana bergantung pada keadaan awal dan keadaan akhir reaksi
Contoh :
Þ Akibat pemutusan ikatan-ikatan kimia dan pembentukan ikatan kimia yang baru.
(Penerimaan energi) (Pembebasan energi)
Energi Ikatan Þ Jumlah energi yang diperlukan untuk memutuskan ikatan antar atom dalam 1 mol molekul berwujud gas.
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
Contoh :
1. Hitunglah perubahan entalpi reaksi : CH4 + 4Cl2 → CCl4 + 4HCl. Jika diketahui : C – H = 415 kJ/mol; C – Cl = 330 kJ/mol; Cl – Cl = 243 kJ/mol; H – Cl = 432 kJ/mol
Jawab :
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
= [ 4 C – H + 4 Cl – Cl ] – [ 4 C – Cl + 4 H – Cl]
= [ 4 (415) + 4 (243) ] – [ 4 (330) + 4 (432) ]
= 2632 – 3048 = – 416 kJ
2. Hitunglah energi ikatan rata-rata N – H dalam molekul NH3. Jika diketahui : ∆H NH3 = – 46,3 kJ, H – H = 436 kJ dan N ≡ N = 946 kJ
Jawab : N2 + 3H2 → 2NH3 ∆H = – 46,3 kJ
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
-46,3 kJ = [ N ≡ N + 3 H – H ] – [ 2 ( 3 N – H) ]
-46,3 kJ = [ 946 + 3 (436) ] – [ 6 ( N – H ) ]
N – H = = 391,1 kJ

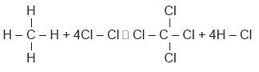
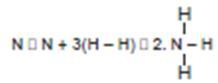
Tidak ada komentar:
Posting Komentar